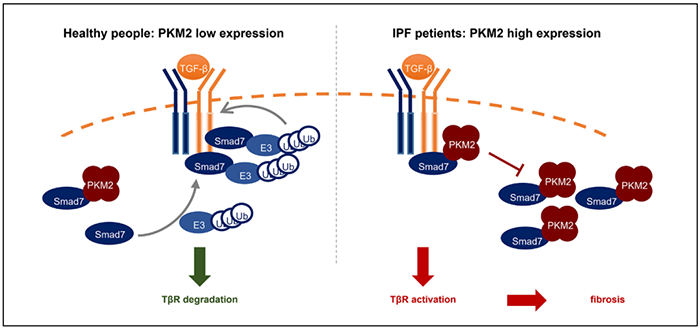
特发性肺纤维化(idiopathic pulmonary fibrosis, IPF)是一种慢性进展性纤维化肺病,目前认为其发病机制主要包括肺泡上皮细胞损伤修复异常和肌成纤维细胞的过度活化【1】,导致细胞外基质(extracellular matrix, ECM)过度沉积,形成肺纤维化灶【2】。IPF发病的分子信号机制尚不完全清晰,但目前认为,转化生长因子(transforming growth factor, TGF)β1信号是促进IPF进展的核心调控信号【3】。TGF-β1信号活化主要受Smad家族调控,TGF-β I型受体(TGF-β type II receptor, TβRI)通过激活下游Smad2/3启动多种促纤维化因子表达【4】,与此同时行使负调控功能的Smad7也通过泛素蛋白酶体途径对TβRI进行降解【5】,以维持TGF-β1信号的平衡;Smad7功能失调导致的TGF-β1信号过度活化是促进纤维化进展的重要原因。丙酮酸激酶(pyruvate kinase, PK)M2亚型是糖酵解级联反应的最后一步限速酶。PKM2通过变构调节行使不同功能,一方面,PKM2四聚体具有活跃的丙酮酸激酶活性,通过发挥Warburg效应调控肿瘤代谢【6】;另一方面,PKM2二聚体又能行使蛋白激酶的功能,通过核转位调控肿瘤相关基因的表达【7】。目前有关PKM2的研究主要集中于代谢相关途径,参与分子信号转导的作用还较少被揭示;同时,PKM2在IPF进展中的作用也尚不完全清楚。2022年9月21日,南开大学药学院杨诚教授课题组在Science Advances在线发表了题为PKM2 promotes pulmonary fibrosis by stabilizing TGF-β1 receptor I and enhancing TGF-β1 signaling的研究论文。该研究报道了PKM2四聚体通过直接与Smad7的MH2结构域互作,干扰Smad7与TβRI的结合,降低TβRI的泛素化降解水平,从而增强TGF-β1信号,促进肺纤维化进展。利用小分子药物或脂质体纳米颗粒(lipid nanoparticle, LNP)包裹的小核酸干扰PKM2四聚体能够有效缓解博来霉素(bleomycin, BLM)诱导的小鼠肺纤维化水平。该研究首次揭示了PKM2参与TGF-β1信号调控的分子机制以及PKM2促进IPF进展的作用,提示了PKM2作为IPF新药研发潜在靶点的可能性。该研究首先发现在IPF患者和BLM诱导的肺纤维化小鼠肺组织中PKM2的表达异常升高,且PKM2的表达与关键促纤维化因子α平滑肌蛋白(α smooth muscle actin, α-SMA)和I型胶原(Collagen I, Col1)呈正相关,预示PKM2是促进纤维化进展的重要因素。同时,在BLM诱导的肺纤维化小鼠中,PKM2主要是在成纤维细胞(fibroblast)而非肺泡II型细胞(alveolar type II cell, AT2)中异常表达,且PKM2四聚体的比例也随着纤维化进展而不断升高。PKM2缺失能够显著缓解BLM诱导的小鼠肺纤维化的水平,表现在降低纤维化面积、肺组织胶原沉积、关键促纤维化因子的表达和TGF-β1信号活化等方面。PKM2缺失能够显著缓解肌成纤维细胞(myofibroblast)活化;利用RNA-seq进一步分析,发现在BLM小鼠原代肺成纤维细胞中,PKM2缺失显著抑制TGF-β1信号转导。团队进一步利用免疫共沉淀(coimmunoprecipitation, co-IP)、微量热涌动(microscale thermophoresis, MST)等技术,确认PKM2调控TGF-β1信号活化主要是通过其四聚体直接与Smad7互作。PKM2过表达能够显著增强TGF-β1诱导的Smad3信号活化,然而其点突变体K305Q(PKM2单体)则无法增强TGF-β1信号,预示PKM2是通过四聚体发挥作用。通过对Smad7进行截短,团队发现PKM2直接与Smad7的MH2结构域相互作用;同时,团队也确认了PKM2主要通过Arg316和Glu397实现与Smad7的结合,表现在PKM2两个点突变体R316L和E397A显著降低了过表达PKM2导致的TGF-β1信号的活化。核质分离后co-IP以及confocal实验进一步确认PKM2与Smad7的互作发生在细胞质而非核内,进一步说明是PKM2四聚体通过在细胞质与Smad7结合增强了TGF-β1信号(图1)。
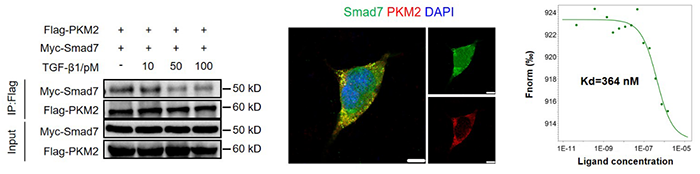
由于Smad7与TβR1的结合主要依赖于MH2结构域【8】,PKM2与Smad7的结合竞争了Smad7与TβR1的结合,且PKM2表达量的升高会剂量依赖性地减少Smad7与TβR1的结合。因此,PKM2敲降能够增强Samd7介导的TβR1泛素化水平,促进TβR1进入到蛋白酶体途径发生降解,实现对TβR1翻译后水平的调控。团队又在IPF患者原代肺成纤维细胞中验证了以上生理过程,证明PKM2能够通过与Smad7结合促进IPF进展。最后,团队从治疗策略的角度出发,研究了对于PKM2四聚体的干扰能否缓解BLM诱导的小鼠肺纤维化。一方面,团队选择了PKM2的小分子抑制剂compound 3k【9】,能够将PKM2从四聚体解聚为单体;另一方面,团队利用靶向肺组织的LNP包裹了PKM2小核酸,能够特异性地在肺组织中降低PKM2的表达水平。两种治疗策略均能够有效缓解BLM诱导的小鼠肺纤维化产生、胶原沉积和促纤维化因子的表达,预示靶向PKM2可能是潜在的IPF治疗策略。综上,本研究主要的生物学意义是:1. 揭示了PKM2通过与Smad7互作干扰Smad7与TβR1的结合,抑制TβR1的泛素化降解,增强TGF-β1信号活化;2. 揭示了PKM2在IPF进展中的作用主要是通过调控TGF-β1信号实现;3. 预示PKM2可能是一个IPF新药研发的潜在靶蛋白。
通讯作者为南开大学药学院杨诚教授,周红刚教授和杨光副教授,和南开大学生命科学学院宁文教授;第一作者为南开大学博士生高劭妍,姜秋燕和博士后李霄鹤。
原文链接:
http://doi.org/10.1126/sciadv.abo0987
1. P. Spagnolo, V. Cottin, Genetics of idiopathic pulmonary fibrosis: from mechanistic pathways to personalised medicine. J Med Genet 54, 93-99 (2017).
2. C. E. Barkauskas, P. W. Noble, Cellular mechanisms of tissue fibrosis. 7. New insights into the cellular mechanisms of pulmonary fibrosis. Am J Physiol Cell Physiol 306, C987-996 (2014).
3. F. J. Martinez, H. R. Collard, A. Pardo, G. Raghu, L. Richeldi, M. Selman, J. J. Swigris, H. Taniguchi, A. U. Wells, Idiopathic pulmonary fibrosis. Nature reviews. Disease primers 3, 17074 (2017).
4. H. Ikushima, K. Miyazono, TGFbeta signalling: a complex web in cancer progression. Nature reviews. Cancer 10, 415-424 (2010).
5. P. Kavsak, R. K. Rasmussen, C. G. Causing, S. Bonni, H. Zhu, G. H. Thomsen, J. L. Wrana, Smad7 binds to Smurf2 to form an E3 ubiquitin ligase that targets the TGF beta receptor for degradation. Molecular cell 6, 1365-1375 (2000).
6. M. G. Vander Heiden, L. C. Cantley, C. B. Thompson, Understanding the Warburg effect: the metabolic requirements of cell proliferation. Science (New York, N.Y.) 324, 1029-1033 (2009).
7. W. Yang, Y. Xia, H. Ji, Y. Zheng, J. Liang, W. Huang, X. Gao, K. Aldape, Z. Lu, Nuclear PKM2 regulates β-catenin transactivation upon EGFR activation. Nature 480, 118-122 (2011).
8. A. Hanyu, Y. Ishidou, T. Ebisawa, T. Shimanuki, T. Imamura, K. Miyazono, The N domain of Smad7 is essential for specific inhibition of transforming growth factor-beta signaling. The Journal of cell biology 155, 1017-1027 (2001).
9. X. Ning, H. Qi, R. Li, Y. Li, Y. Jin, M. A. McNutt, J. Liu, Y. Yin, Discovery of novel naphthoquinone derivatives as inhibitors of the tumor cell specific M2 isoform of pyruvate kinase. Eur J Med Chem 138, 343-352 (2017).
















